Selecionar Exercício
Num laboratório, um grupo de alunos pretende titular, com rigor, uma solução aquosa de hidróxido de sódio, $\mathrm{NaOH}(\mathrm{aq})$, utilizando uma solução-padrão de ácido clorídrico, $\mathrm{HCl}(\mathrm{aq})$, de concentração $0,280 \mathrm{~mol} \mathrm{~dm}^{-3}$. A reação que ocorre pode ser traduzida por
Questão:
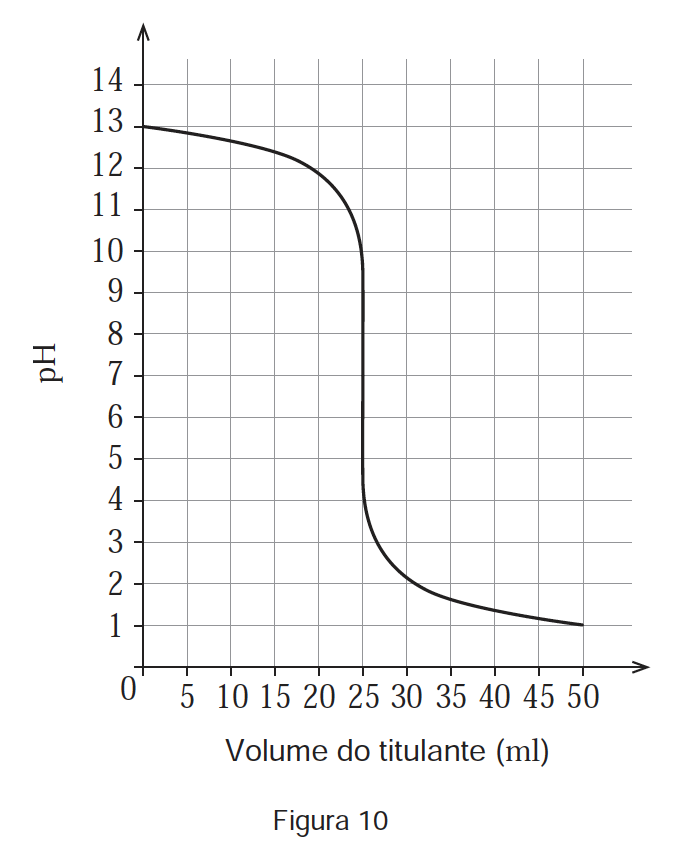
Uma solução aquosa de $80,0 \mathrm{ml}$ de $\mathrm{NaOH}\left(M=40,00 \mathrm{~g} \mathrm{~mol}^{-1}\right)$ foi preparada a partir de uma amostra impura do reagente sólido, da qual se gastou $1,20 \mathrm{~g}$. Retiraram-se $20,0 \mathrm{~ml}$ dessa solução e titulou-se esta quantidade de solução com a solução-padrão de $\mathrm{HCl}$, tendo-se obtido a curva de titulação representada na Figura 10.
Admita que as impurezas são inertes.
Calcule a massa de impurezas na amostra inicial de $\mathrm{NaOH}$.
Apresente todos os cálculos efetuados.
Comentários
Para responder ao comentário, por favor inicia sessão ou cria uma conta.
Para comentar, por favor inicia sessão ou cria uma conta.
